
Văzând Referatul de aprobare al Direcţiei sănătate publică şi control în sănătate publică nr. R.A. 368/2012, în temeiul art. 7 alin. (4) din Hotărârea Guvernului nr. 144/2010 privind organizarea şi funcţionarea Ministerului Sănătăţii, cu modificările şi completările ulterioare, al art. 16 alin. (4) din Hotărârea Guvernului nr. 544/2012 privind organizarea şi funcţionarea Ministerului Mediului şi Pădurilor, cu modificările ulterioare, şi al art. 4 alin. (3) din Hotărârea Guvernului nr. 1.415/2009 privind organizarea şi funcţionarea Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor şi a unităţilor din subordinea acesteia, cu modificările şi completările ulterioare, ministrul sănătăţii, ministrul mediului şi pădurilor şi preşedintele Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor emit prezentul ordin. Articolul I Normele metodologice de aplicare a Hotărârii Guvernului nr. 956/2005 privind plasarea pe piaţă a produselor biocide, aprobate prin Ordinul ministrului sănătăţii publice, al ministrului mediului şi gospodăririi apelor şi al preşedintelui Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor nr. 1.321/2006/280/90/2007, publicat în Monitorul Oficial al României, Partea I, nr. 286 din 2 mai 2007, cu modificările şi completările ulterioare, se modifică şi se completează după cum urmează: 1. Articolul 1 se modifică şi va avea următorul cuprins: Articolul 1(1) Pentru obţinerea autorizaţiei, în conformitate cu prevederile art. 35 din Hotărârea Guvernului nr. 956/2005 privind plasarea pe piaţă a produselor biocide, cu modificările şi completările ulterioare, solicitantul depune la Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide:
a)pentru produsul biocid:
|
|
(i) |
cererea de autorizare (în original), semnată de către solicitant; |
|
|
(ii) |
scrisoare de intenţie (în original), semnată de către solicitant; |
|
|
(iii) |
formular de cerere generat prin Registrul european al produselor biocide, denumit în continuare R4BP, semnat de către solicitant; |
|
|
(iv) |
dosar al produsului biocid (în copie) sau scrisoare de acces (în original) semnată de către deţinătorul datelor care au fost utilizate pentru includerea substanţei în anexa nr. I sau IA, care să satisfacă, ţinând cont de evoluţia cunoştinţelor ştiinţifice şi tehnice, cerinţele prevăzute în anexa nr. IIB şi, unde este cazul, în părţile relevante ale anexei nr. IIIB; |
|
|
(v) |
dovada achitării tarifelor (în original), în conformitate cu prevederile art. 76 din Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare; |
b)pentru fiecare substanţă activă conţinută în produsul biocid dosarul (în copie) sau scrisoare de acces (în copie) semnată de către deţinătorul datelor care au fost utilizate pentru includerea substanţei în anexa nr. I sau IA, care să satisfacă cerinţele prevăzute în anexa nr. IIA şi, după caz, în părţile relevante ale anexei nr. IIIA. (2) Pentru fiecare produs biocid, documentele prevăzute la alin. (1) se depun în 6 exemplare: un exemplar pe suport hârtie şi 5 exemplare pe suport electronic CDROM/DVD. 2. După articolul 1 se introduc cinci noi articole, articolele 11 , 12 , 13 , 14 și 15 , cu următorul cuprins: Articolul 11 În sensul prezentelor norme metodologice se aplică atât definiţiile prevăzute la art. 10 din Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare, cât şi următorii termeni şi expresii, definiţi astfel: a)produs biocid existent:1. este produsul care a fost deja plasat pe piaţa României la data includerii substanţei sale active în anexa nr. I sau IA, corespunzător tipului de produs respectiv (prevăzut în anexa nr. 2 la Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare), şi care deţine aviz în conformitate cu prevederile art. 92 alin. (2) din Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare, şi ale Ordinului ministrului sănătăţii, al ministrului mediului şi pădurilor şi al preşedintelui Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor nr. 10/368/11/2010 privind aprobarea procedurii de avizare a produselor biocide care sunt plasate pe piaţă pe teritoriul României; sau 2. este produsul a cărui sursă de substanţă activă este schimbată de la un furnizor iniţial la un furnizor care deţine un dosar complet al substanţei active, aşa cum este prevăzut la art. 1-4 şi 9-11; b)produs biocid nou este produsul care nu a fost plasat pe piaţa României la data includerii substanţei sale active în anexa nr. I sau IA, corespunzător tipului de produs respectiv, prevăzut în anexa nr. 2 la Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare. În cazul produselor biocide care conţin mai multe substanţe active, sintagma „produs biocid nou“ se referă la produsele biocide care nu au fost plasate pe piaţa României la data includerii ultimei substanţe active în anexa nr. I sau IA, corespunzător tipului de produs respectiv, prevăzut în anexa nr. 2 la Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare; c)stat membru de referinţă este primul stat membru al Uniunii Europene care a emis o autorizaţie sau a înregistrat un produs biocid; d)stat membru în cauză este statul membru al Uniunii Europene care a primit o solicitare de recunoaştere mutuală a autorizaţiei pentru plasarea pe piaţă a produselor biocide sau a înregistrării pentru plasarea pe piaţă a produselor biocide; e)R4BP, care este administrat de către Comisia Europeană, cuprinde lista produselor pentru care au fost înaintate solicitări pentru plasarea pe piaţă a produselor biocide, precum şi principalele informaţii despre procedurile de autorizare/ înregistrare pentru plasarea pe piaţă a produselor biocide/produselor biocide cu risc scăzut şi de recunoaştere mutuală a autorizaţiilor/înregistrărilor pentru plasarea pe piaţă a produselor biocide/produselor biocide cu risc scăzut. R4BP este disponibil pe site-ul web al Comisiei Europene la adresa: https://webgate.ec.europa.eu/env/r4bp. R4BP se completează de către solicitanţi şi autorităţile competente din fiecare stat membru al Uniunii Europene. Articolul 12 Prevederile din prezentele norme metodologice se aplică în mod similar procedurii de înregistrare a produselor biocide cu risc scăzut. Articolul 13 (1) Persoanele juridice care intenţionează să continue comercializarea pe teritoriul României a unui produs biocid existent trebuie să depună la Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide, până cel târziu la data înscrisă în coloana 5 «Data includerii» din tabelul prevăzut în anexa nr. I sau IA, următoarele documente:
a)cerere de autorizare;sau b)cerere de recunoaştere mutuală. (2) De la prevederile alin. (1) fac excepţie produsele care conţin mai multe substanţe active, pentru care termenul-limită de plasare pe piaţă în conformitate cu prevederile art. 92 alin. (2) din Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare, este cel prevăzut în ultima decizie de includere a substanţelor active ale respectivelor produse în anexa nr. I sau IA. Articolul 14 Persoanele juridice pot solicita prima autorizare în oricare dintre statele membre. Articolul 15 Plasarea pe piaţa României a produselor biocide noi se realizează după obţinerea autorizaţiei sau după recunoaşterea mutuală a acesteia, conform prevederilor prezentelor norme metodologice. 3. La articolul 2, după alineatul (3) se introduce un nou alineat, alineatul (4) , cu următorul cuprins: (4) Pentru prezentarea dosarelor prevăzute la alin. (1) se utilizează instrumentul informatic IUCLID 5. 4. După articolul 8 se introduce un nou articol, articolul 81 , cu următorul cuprins: Articolul 81 (1) În conformitate cu prevederile art. 4 din Regulamentul (CE) nr. 1.451/2007 al Comisiei din 4 decembrie 2007 privind a doua etapă a programului de lucru de 10 ani prevăzut la articolul 16 alineatul (2) din Directiva 98/8/CE a Parlamentului European şi a Consiliului privind introducerea pe piaţă a produselor biocide, atunci când se adoptă o decizie de a nu include o substanţă activă în anexa I sau IA la Directiva 98/8/CE a Parlamentului European şi a Consiliului din 16 februarie 1998 privind comercializarea produselor biodestructive pentru un anumit tip de produs biocid prevăzut în anexa nr. 2 la Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare, produsele biocide aparţinând acelui tip şi care conţin respectiva substanţă activă vor fi retrase de pe piaţa României în decurs de 12 luni de la publicarea deciziei în Jurnalul Oficial al Uniunii Europene, disponibil pe site-ul web al Comisiei Europene la adresa: https://ec.europa.eu/comm/environment/biocides/index.htm, cu excepţia cazului în care există alte dispoziţii specifice în decizia de neincludere.
(2) Prevederile alin. (1) se aplică şi produselor biocide care conţin şi alte substanţe active pe lângă substanţa activă în cauză. 5. Articolul 9 se modifică şi va avea următorul cuprins: Articolul 9(1) Evaluarea produselor biocide şi a produselor biocide cu risc scăzut în vederea autorizării şi înregistrării se face în ceea ce priveşte: efectele asupra sănătăţii oamenilor, efectele asupra sănătăţii animalelor, efectele asupra mediului înconjurător, eficacitatea, proprietăţile fizico-chimice.
(2) Responsabilităţile pentru evaluarea produselor biocide şi a produselor biocide cu risc scăzut se realizează de către experţii desemnaţi ţinând cont de expertiza acestora, după cum urmează:
a)pentru evaluarea proprietăţilor fizico-chimice ale produselor biocide şi a echivalenţei tehnice a substanţelor active, experţi din cadrul instituţiilor aflate în coordonarea Ministerului Mediului şi Pădurilor pentru tipurile de produse 1-23; b)pentru evaluarea eficacităţii produselor biocide:
|
|
(i) |
experţi din cadrul Institutului Naţional de Sănătate Publică din subordinea Ministerului Sănătăţii pentru tipurile de produse 1, 2, 5-19, 22; |
|
|
(ii) |
experţi din cadrul Institutului pentru Controlul Produselor Biologice şi Medicamentelor de Uz Veterinar din subordinea Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor pentru tipurile de produse 3, 4, 20; |
|
|
(iii) |
experţi ai instituţiilor aflate în coordonarea Ministerului Mediului şi Pădurilor pentru tipurile de produse 21, 23; |
c)pentru evaluarea efectelor toxicologice ale produselor biocide asupra oamenilor, experţi din cadrul Institutului Naţional de Sănătate Publică din subordinea Ministerului Sănătăţii pentru tipurile de produse 1-23; d)pentru evaluarea efectelor toxicologice ale produselor biocide asupra animalelor, experţi din cadrul Institutului pentru Controlul Produselor Biologice şi Medicamentelor de Uz Veterinar din subordinea Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor pentru tipurile de produse 1-23, după caz; e)pentru evaluarea ecotoxicologică şi a comportării în mediu a produselor biocide, experţi din cadrul Agenţiei Naţionale pentru Protecţia Mediului si alte instituţii aflate în coordonarea Ministerului Mediului şi Pădurilor pentru tipurile de produse 1-23. (3) Distribuirea dosarelor şi/sau CD-urilor în vederea evaluărilor prevăzute la alin. (2) lit. a) se realizează de către Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide în ordinea înregistrării, câte un exemplar la fiecare dintre instituţiile menţionate. 6. După articolul 10 se introduce un nou articol, articolul 101 , cu următorul cuprins: Articolul 101 (1) În termen de 90 de zile calendaristice de la primirea solicitării de autorizare sau înregistrare a unui produs biocid, Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide verifică dacă dosarul este complet şi dacă substanţa activă corespunde celei incluse în anexa nr. I sau IA şi comunică solicitantului situaţia existentă. În cazul în care se constată lipsa unor documente din dosar, Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide va cere solicitantului completarea dosarului, astfel încât acesta să aibă la dispoziţie 30 de zile, respectându-se termenul de 90 de zile din prezentul alineat.
(2) Dacă la sfârşitul termenului prevăzut la alin. (1) dosarul este considerat incomplet, Comisia Naţională pentru Produse Biocide dispune retragerea de pe piaţă a produsului biocid şi acordă o perioadă de graţie de 6 luni pentru producerea şi comercializarea produsului biocid şi de încă 6 luni pentru utilizarea, depozitarea şi eliminarea stocurilor de produs biocid existente la comerciant.
(3) În conformitate cu principiile comune pentru evaluarea produselor biocide stabilite în anexa nr. VI, după finalizarea perioadei de evaluare de către experţi în decurs de 12 luni de la data la care dosarul produsului biocid a fost considerat ca fiind complet, Comisia Naţională pentru Produse Biocide decide asupra autorizării pentru punerea pe piaţă a produsului biocid.
(4) În conformitate cu principiile comune pentru evaluarea produselor biocide stabilite în anexa nr. VI, după finalizarea evaluării de către experţi, în decurs de două luni de la data la care dosarul produsului biocid a fost considerat ca fiind complet, Comisia Naţională pentru Produse Biocide decide asupra înregistrării pentru punerea pe piaţă a produsului biocid.
(5) Dacă experţii consideră că sunt necesare date suplimentare celor înaintate de către solicitant, aceştia anunţă Secretariatul tehnic, care notifică atât solicitantul, cât şi statele membre în cauză şi Comisia Europeană asupra deciziei de întrerupere a procesului de evaluare.
(6) Pentru evaluarea produselor biocide şi luarea deciziei de autorizare sau înregistrare se ţine cont de Manualul pentru luarea deciziilor şi de ghidurile tehnice ale Comisiei Europene, disponibile pe site-ul web al Comisiei Europene la adresa: https://ec.europa.eu/comm/environment/biocides/index.htm.
(7) Comisia Naţională pentru Produse Biocide comunică Comisiei Europene şi celorlalte state membre ale Uniunii Europene lista cu produsele biocide autorizate şi înregistrate prin R4BP, în conformitate cu prevederile art. 58 din Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare.
(8) Dacă România, în calitate de stat membru de referinţă, ajunge la concluzia că autorizaţia pentru punerea pe piaţă a produselor biocide nu poate să fie emisă în urma evaluării unui produs biocid pentru care există solicitări de recunoaştere mutuală a autorizaţiei, informează, prin intermediul Comisiei Naţionale pentru Produse Biocide, statele membre în cauză în termen de 5 zile lucrătoare, înaintea luării deciziei finale. După caz, înaintea luării deciziei finale, Comisia Naţională pentru Produse Biocide se consultă cu autorităţile competente din statele membre în cauză asupra acestor motive.
(9) Pentru produsul biocid, asupra căruia Comisia Naţională pentru Produse Biocide a decis că nu poate fi autorizat sau înregistrat, se anulează actul administrativ în cauză, prin transmiterea către deţinător a formularului de înştiinţare privind retragerea de pe piaţă a produsului biocid, şi se acordă o perioadă de graţie de 6 luni pentru producere şi comercializare şi încă 6 luni pentru utilizare, depozitare şi eliminare a stocurilor existente la comerciant de la data emiterii deciziei. 7. Articolul 12 se modifică şi va avea următorul cuprins: Articolul 12(1) Pentru recunoaşterea mutuală a autorizaţiilor produselor biocide, în conformitate cu prevederile art. 19 alin. (3) din Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare, solicitantul depune la Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide:
a)în prima etapă:
|
|
(i) |
cerere pentru recunoaştere mutuală a produsului biocid (în original), semnată de către solicitant; |
|
|
(ii) |
formular de cerere generat prin R4BP (în original), semnat de către solicitant; |
|
|
(iii) |
scrisoare de acces (în original), semnată de către deţinătorul datelor care au fost utilizate pentru includerea substanţei în anexa nr. I sau IA; |
|
|
(iv) |
dovada achitării tarifului către Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide; |
b)în a doua etapă, în termen de 60 de zile calendaristice de la obţinerea autorizaţiei produsului biocid:
|
|
(i) |
document de prezentare a produsului biocid (în original), semnat de către solicitant; |
|
|
(ii) |
autorizaţia produsului biocid emisă de statul membru de referinţă (în copie legalizată); |
|
|
(iii) |
raportul de evaluare efectuat în statul membru de referinţă (în copie); |
|
|
(iv) |
rezumatul dosarului produsului biocid (în copie), aşa cum a fost înaintat către statul membru de referinţă; |
|
|
(v) |
fişa cu date de securitate pentru produsul biocid (în copie); |
|
|
(vi) |
proiect de etichetă pentru produsul biocid (în copie); |
|
|
(vii) |
dovada achitării tarifelor către toate instituţiile implicate în evaluare. |
(2) În termen de 15 zile lucrătoare de la depunerea documentelor precizate la alin. (1) lit. a), Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide comunică solicitantului decizia de acceptare a documentelor prezentate în prima etapă, precum şi detalii referitoare la instituţiile implicate în evaluare în vederea achitării tarifelor.(3) Toate documentele necesare pentru recunoaşterea mutuală a autorizaţiilor produselor biocide sunt prezentate în limba română şi în limba engleză. (4) Pentru fiecare produs biocid, documentele prevăzute la alin. (1) se depun în 6 exemplare: un exemplar pe suport hârtie şi 5 exemplare pe suport electronic CDROM/DVD. (5) Solicitantul are obligaţia să depună copia legalizată a autorizaţiei produsului biocid obţinute în statul membru de referinţă, simultan în toate statele membre în cauză.(6) Dacă în termen de 60 de zile calendaristice de la data acordării primei autorizaţii Secretariatul tehnic nu primeşte copia legalizată a autorizaţiei produsului biocid, Comisia Naţională pentru Produse Biocide dispune retragerea de pe piaţă a produsului prin transmiterea către deţinător a formularului de înştiinţare privind retragerea de pe piaţă şi acordă o perioadă de graţie de 6 luni pentru comercializare, utilizare, depozitare şi eliminare a stocurilor existente de produs biocid. (7) Pentru recunoaşterea mutuală a înregistrărilor produselor biocide cu risc scăzut, în conformitate cu prevederile art. 19 alin. (4) din Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare, solicitantul depune la Secretariatul tehnic cererea pentru recunoaşterea mutuală a înregistrărilor produselor biocide şi dosarul cu datele specificate la art. 36 al aceleiaşi hotărâri de Guvern.(8) Secretariatul tehnic verifică integralitatea administrativă a dosarului în termen de 20 de zile calendaristice de la depunerea acestuia de către solicitant.(9) Comisia Naţională pentru Produse Biocide decide asupra recunoaşterii mutuale a primei autorizaţii pentru plasarea pe piaţă a produselor biocide, emisă de un stat membru de referinţă pentru produsele biocide a căror substanţă activă este inclusă în anexa nr. I pe baza raportului experţilor, în termen de 120 de zile calendaristice de la primirea documentelor prevăzute la alin. (1), ţinând cont de etapele şi termenele corespunzătoare derulării activităţilor aferente, astfel:a)transmiterea de către Secretariatul tehnic al Comisiei Naţionale pentru Produse Biocide a dosarului către celelalte instituţii - 10 zile calendaristice; b)evaluarea primară a documentelor din dosar - 10 zile calendaristice; c)evaluarea propriu-zisă şi întocmirea rapoartelor de evaluare - 40 de zile calendaristice; d)întocmirea raportului de evaluare, luarea deciziei în cadrul şedinţei Comisiei Naţionale pentru Produse Biocide şi emiterea certificatului pentru plasarea pe piaţă a produsului biocid - 60 de zile calendaristice. (10) Secretariatul tehnic înaintează Comisiei Naţionale pentru Produse Biocide dosarele pentru procesul decizional privind recunoaşterea mutuală a autorizaţiilor sau a înregistrărilor produselor biocide.(11) În decurs de 60 de zile calendaristice de la primirea copiei legalizate a certificatului de autorizare prin recunoaştere mutuală a înregistrării, Comisia Naţională pentru Produse Biocide decide asupra recunoaşterii mutuale a primei înregistrări emise de un stat membru de referinţă pentru produsele biocide a căror substanţă activă este inclusă în anexa nr. IA, ţinând cont de etapele şi termenele corespunzătoare derulării activităţilor aferente, astfel:a)verificarea completitudinii dosarului - 10 zile calendaristice; b)întocmirea raportului - 20 de zile calendaristice; c)luarea deciziei în şedinţa Comisiei Naţionale pentru Produse Biocide şi emiterea certificatului pentru plasarea pe piaţă a produsului biocid - 30 de zile calendaristice. (12) Perioada prevăzută la alin. (11) poate fi prelungită cu maximum 90 de zile calendaristice, în cazul în care se întrunesc elementele constitutive ale art. 21 din Hotărârea Guvernului nr. 956/2005, cu modificările şi completările ulterioare.(13) Rapoartele de evaluare şi rezumatul dosarelor în limba engleză pentru produsele biocide autorizate care urmează să fie recunoscute mutual sunt disponibile numai autorităţilor competente din statele membre ale Uniunii Europene prin portalul Administratorului Centrului pentru Resurse de Comunicare şi Informare (CIRCA) al Comisiei Europene.(14) Pentru recunoaşterea mutuală a autorizaţiilor produselor biocide existente pe piaţă în România la data includerii substanţei active în anexa nr. I şi pentru care nu s-a solicitat obţinerea recunoaşterii mutuale conform alin. (1) lit. a) subpct. (ii), nu se aplică termenul prevăzut la alin. (1) lit. b) şi nici prevederile alin. (6). 8. După articolul 13 se introduc trei noi articole, articolele 131 , 132 și 133 , cu următorul cuprins: Articolul 131 (1) Produsele biocide pentru care au fost înaintate la termenele-limită stabilite documentele prevăzute în prezentul ordin pot fi comercializate în continuare pe durata evaluării acestora.
(2) În cazul produselor biocide ale căror documente prevăzute în prezentele norme metodologice nu au fost înaintate, au fost incomplete sau nu au fost înaintate până la termenele-limită stabilite în prezentul ordin, Comisia Naţională pentru Produse Biocide anulează actul administrativ în cauză prin transmiterea către deţinător a formularului de înştiinţare privind retragerea de pe piaţă a produsului biocid, corespunzător tipului respectiv, şi informează autoritatea competentă, care acordă o perioadă de graţie de 6 luni pentru comercializare şi de încă 6 luni pentru utilizare, depozitare şi eliminare a stocurilor existente, de la data înscrisă în coloana 5 «Data includerii» din tabelul prevăzut în anexa nr. I sau IA. Articolul 132 Termenele-limită şi procedurile prevăzute în prezentele norme metodologice nu trebuie să afecteze acţiunile rapide întreprinse de statele membre ale Uniunii Europene sau Comisia Europeană în cazuri speciale de protecţie a mediului sau de protecţie a sănătăţii oamenilor şi animalelor. Articolul 133 Modelul de certificat pentru plasarea pe piaţă a produsului biocid este prevăzut în anexa nr. VII. 9. La articolul 14, alineatul (1) se modifică şi va avea următorul cuprins: Articolul 14(1) Anexele nr. I, IA, IIA, IIB, IIIA, IIIB, IVA, IVB, VI şi VII fac parte integrantă din prezentele norme metodologice. 10. După anexa nr. VI se introduce o nouă anexă, anexa nr. VII , având cuprinsul prevăzut în anexa care face parte integrantă din prezentul ordin. Articolul II Prezentul ordin se publică în Monitorul Oficial al României, Partea I, şi intră în vigoare în termen de 15 zile calendaristice de la data publicării. Articolul III Ordinul ministrului sănătăţii publice, al ministrului mediului şi gospodăririi apelor şi al preşedintelui Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor nr. 1.321/2006/280/90/2007 pentru aprobarea Normelor metodologice de aplicare a Hotărârii Guvernului nr. 956/2005 privind plasarea pe piaţă a produselor biocide, publicat în Monitorul Oficial al României, Partea I, nr. 286 din 2 mai 2007, cu modificările şi completările ulterioare, precum şi cu cele aduse prin prezentul ordin, se va republica în Monitorul Oficial al României, Partea I, dându-se textelor o nouă numerotare. Ministrul sănătăţii, Raed Arafat Ministrul mediului şi pădurilor, Rovana Plumb p. Preşedintele Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor, Vladimir Alexandru Mănăstireanu ANEXĂ (Anexa nr. VII la normele metodologice) CERTIFICAT Nr. ........ pentru plasarea pe piaţă a produsului biocid În conformitate cu Hotărârea Guvernului nr. 956/2005 privind plasarea pe piaţă a produselor biocide, cu modificările şi completările ulterioare, cu Ordinul ministrului sănătăţii publice, al ministrului mediului şi pădurilor şi al preşedintelui Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor nr. 1.321/2006/280/90/2007 pentru aprobarea Normelor metodologice de aplicare a Hotărârii Guvernului nr. 956/2005 privind plasarea pe piaţă a produselor biocide, cu modificările şi completările ulterioare, şi cu Ordinul ministrului sănătăţii, al ministrului mediului şi pădurilor şi al preşedintelui Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor nr. 637/2.492/50/2012 privind aprobarea membrilor Comisiei naţionale pentru produse biocide şi a regulamentului de organizare şi funcţionare a acesteia, în baza documentelor depuse în dosarul tehnic, Comisia Naţională pentru Produse Biocide, în şedinţa din data ........ .............., a decis că produsul biocid poate fi plasat pe piaţă în România, conform prevederilor legale în vigoare. I. TIPUL CERTIFICATULUI (în raport cu prevederile Hotărârii Guvernului nr. 956/2005 privind plasarea pe piaţă a produselor biocide)  Data eliberării certificatului: Data expirării certificatului: II. IDENTITATEA COMPANIILOR IMPLICATE ÎN PLASAREA PE PIAŢĂ A PRODUSULUI BIOCID
Data eliberării certificatului: Data expirării certificatului: II. IDENTITATEA COMPANIILOR IMPLICATE ÎN PLASAREA PE PIAŢĂ A PRODUSULUI BIOCID
|
|
Solicitant |
Deţinătorul autorizaţiei/înregistrării |
Producător* |
|
Nume |
|
|
|
|
Adresa/ţara |
|
|
|
|
Persoana de contact |
|
|
|
|
Poziţia în companie |
|
|
|
|
Telefon |
|
|
|
|
Fax |
|
|
|
|
E-mail |
|
|
|
* Dacă este diferit de deţinătorul autorizaţiei/înregistrării. III. IDENTITATEA PRODUSULUI BIOCID
|
Denumirea comercială |
|
|
Alte denumiri comerciale, după caz/sinonime |
|
|
Grupa principală (conform anexei nr. 2 la Hotărârea Guvernului nr. 956/2005) |
|
|
Tipul de produs (conform anexei nr. 2 la Hotărârea Guvernului nr. 956/2005) |
|
Prezentul certificat este însoţit de anexa „Sumarul caracteristicilor produsului biocid“, care face parte integrantă din prezentul certificat. Preşedinte, ........ ........ .............. ANEXĂ Sumarul caracteristicilor produsului biocid (denumire ........ ..........) I. INFORMAŢII PRIVIND COMPOZIŢIA PRODUSULUI BIOCID 1. Identitatea substanţei active (substanţelor active) - substanţe chimice 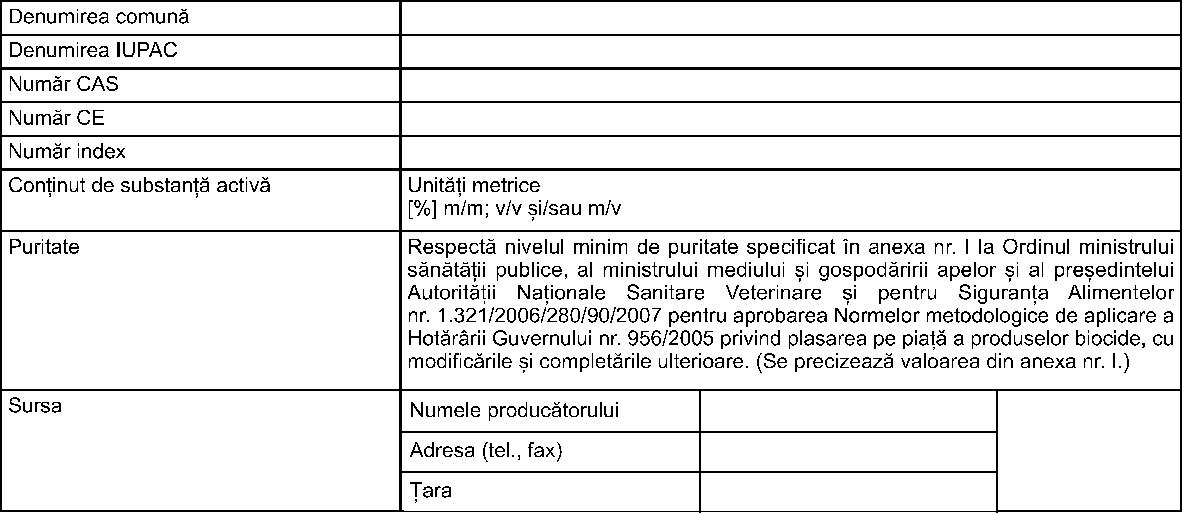 2. Identitatea substanţei active (substanţelor active) - microorganisme
2. Identitatea substanţei active (substanţelor active) - microorganisme 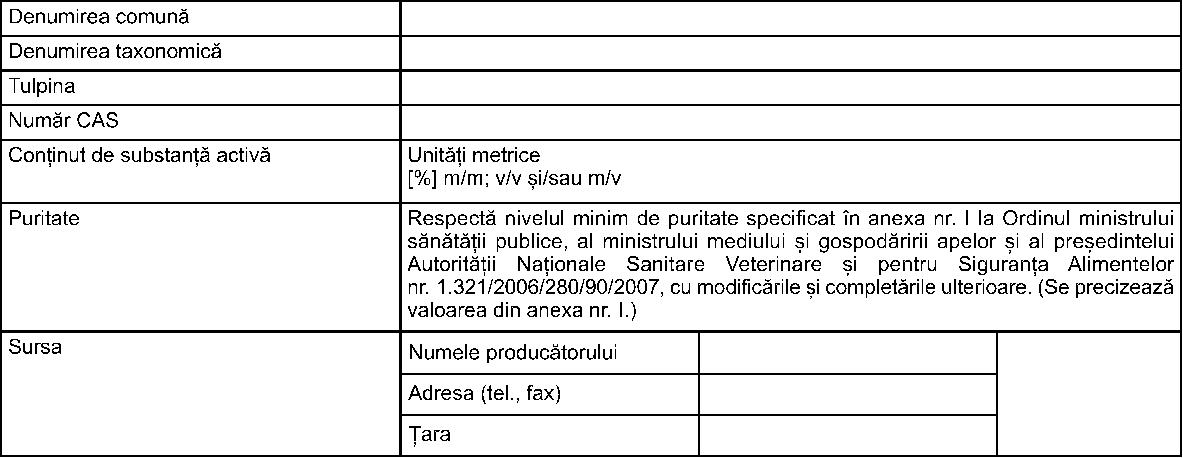 3. Identitatea substanţelor periculoase* care contribuie la clasificarea produsului biocid (i) ........ ................ .............
3. Identitatea substanţelor periculoase* care contribuie la clasificarea produsului biocid (i) ........ ................ .............  (ii) ........ ................ ........ ...........
(ii) ........ ................ ........ ...........  * Altele decât substanţele active, clasificate conform Regulamentului (CE) nr. 1.272/2008. II. UTILIZARE Categoria de utilizatori pentru care este autorizat
* Altele decât substanţele active, clasificate conform Regulamentului (CE) nr. 1.272/2008. II. UTILIZARE Categoria de utilizatori pentru care este autorizat
|
Populaţie |
Profesional |
Industrial |
|
necesită instruire |
nu necesită instruire |
Există restricţie pentru populaţie  Indicaţii pentru fiecare utilizare
Indicaţii pentru fiecare utilizare
|
Concentraţia soluţiei de lucru/Doza de aplicare exprimată în unităţi metrice |
|
|
|
Metoda şi/sau frecvenţa de aplicare |
|
|
|
Timpul de acţiune necesar efectului biocid |
|
|
|
Intervalul de timp care trebuie respectat între utilizările produsului biocid |
|
|
|
Intervalul de timp pentru primul acces al oamenilor sau animalelor în zonele în care s-a folosit produsul biocid |
|
|
|
Perioada de aerisire necesară pentru zonele tratate |
|
|
Domeniul de utilizare
Aria de utilizare  III. FORMULARE ŞI CONDIŢIONARE
III. FORMULARE ŞI CONDIŢIONARE
|
Tip de formulare/tipul preparatului (descriere, precum concentrat lichid, granule, pulbere etc.) |
|
Formulare-cadru, conform art. 10 lit. l) din Hotărârea Guvernului nr. 956/2005 privind plasarea pe piaţă a produselor biocide, cu modificările şi completările ulterioare Există solicitare pentru a fi considerat ca produs de referinţă |
Da Nu |
IV. CARACTERISTICILE FIZICE ŞI CHIMICE
|
|
Caracteristica |
Substanţa activă |
Produs biocid |
|
A.01 |
Temperatura de topire/îngheţare [°C] |
|
|
|
A.02 |
Temperatura de fierbere [°C] |
|
|
|
A.03 |
Densitate [g/cm3] |
|
|
|
A.04 |
Presiunea de vapori [Pa] |
|
|
|
A.05 |
Tensiunea superficială [Pa] |
|
|
|
A.06 |
Solubilitatea în apă [g/l] |
|
|
|
A.08 |
Coeficientul de partiţie octanol-apă - kow |
|
|
|
A.09 |
Punct de inflamabilitate [°C] |
|
|
|
A.10 |
Inflamabilitate (solide) [°C] |
|
|
|
A.11 |
Inflamabilitate (gaze) [°C] |
|
|
|
A.12 |
Inflamabilitate (contactul cu apa) [°C] |
|
|
|
A.13 |
Proprietăţi piroforice ale solidelor şi lichidelor |
|
|
|
A.14 |
Proprietăţi explozive |
|
|
|
A.15 |
Temperatura de autoaprindere (lichide şi gaze) [°C] |
|
|
|
A.16 |
Temperatura de autoaprindere relativă pentru solide [°C] |
|
|
|
A.17 |
Proprietăţi oxidante (solide) |
|
|
V. CLASIFICAREA ŞI ETICHETAREA SUBSTANŢEI ACTIVE 1. Conform tabelului 3.2 din Regulamentul (CE) nr. 1.272/2008
|
Simbol(uri) |
|
|
Fraze de risc (R) |
|
|
Fraze de siguranţă (S) |
|
|
Pictogramă(e) |
|
2. Conform tabelului 3.1 din Regulamentul (CE) nr. 1.272/2008
|
Pictogramă(e) |
|
|
Fraze de pericol (H) |
|
|
Fraze de prudenţă (P) |
|
VI. CLASIFICAREA ŞI ETICHETAREA PRODUSULUI 1. Conform Hotărârii Guvernului nr. 937/2010 privind clasificarea, ambalarea şi etichetarea la introducerea pe piaţă a preparatelor periculoase (Directiva 1999/45/CE a Parlamentului European şi a Consiliului din 31 mai 1999 privind apropierea actelor cu putere de lege şi a actelor administrative ale statelor membre referitoare la clasificarea, ambalarea şi etichetarea preparatelor periculoase)
|
Simbol(uri) |
|
|
Fraze de risc (R) |
|
|
Fraze de siguranţă (S) |
|
|
Pictogramă(e) |
|
2. Conform Regulamentului (CE) nr. 1.272/2008
|
Pictogramă(e) |
|
|
Fraze de pericol (H) |
|
|
Fraze de prudenţă (P) |
|
VII. AMBALAREA PRODUSULUI
|
Capacitate |
|
Restricţii cu privire la dimensiunea/capacitatea de ambalare |
|
Tipul de ambalaj |
|
Materialul ambalajului |
|
Caracteristici specifice legate de siguranţă |
VIII. EVALUAREA RISCURILOR 1. Riscuri pentru sănătatea umană
|
Identificarea pericolelor |
|
Efecte adverse directe sau indirecte |
2. Riscuri specifice pentru mediu
|
Identificarea pericolelor |
|
Efecte adverse directe sau indirecte |
3. Riscuri specifice pentru sănătatea animală
|
Identificarea pericolelor |
|
Efecte adverse directe sau indirecte asupra animalelor şi a hranei pentru animale |
IX. MĂSURI PENTRU PREVENIREA ŞI REDUCEREA RISCURILOR SĂNĂTATEA UMANĂ
|
Instrucţiuni de prim ajutor şi sfaturi medicale |
|
Măsuri de precauţie în perioada utilizării, depozitării şi transportului |
|
Controlul expunerii umane |
|
Măsuri de protecţie a lucrătorilor împotriva riscurilor generate de agenţii biologici la locul de muncă (numai pentru biocidele care au în compoziţie microorganisme) |
MEDIU
|
Instrucţiuni pentru eliminarea în siguranţă a produsului şi ambalajului său |
|
- există interdicţie de refolosire a ambalajului Da Nu |
|
Măsuri în caz de dispersie accidentală |
|
Metode şi măsuri de decontaminare |
|
Indicaţii pentru protejarea organismelor nevizate |
|
Măsuri pentru prevenirea contaminării apei |
SĂNĂTATEA ANIMALĂ
|
Măsuri de precauţie în perioada depozitării, utilizării şi transportului |
|
Controlul expunerii în prezenţa animalelor şi a hranei pentru animale |
|
Măsurile necesare pentru protecţia animalelor şi a hranei pentru animale |
|
Măsuri pentru prevenirea contaminării apei |
|
Măsuri de protecţie împotriva incendiilor |
X. EVALUAREA EFICACITĂŢII BIOCIDE
|
Organismele-ţintă (după caz, inclusiv stadiul de dezvoltare al acestora) |
|
Mod de acţiune (numai în cazul în care organismul-ţintă este un animal vertebrat) |

|
Informaţii privind dezvoltarea rezistenţei/apariţia rezistenţei |